IMMUNOTHERAPIE
Les lymphocytes T-CAR (CAR-T cells)
Résumé tout public
Les traitements des cancers varient selon le type et le stade du cancer, mais les principales thérapies sont les suivantes :
- la chirurgie qui vise à retirer les tumeurs tout en préservant autant de tissus sains que possible,
- la chimiothérapie qui utilise des médicaments pour tuer les cellules cancéreuses ou ralentir leur croissance,
- la radiothérapie qui utilise des rayons X à haute énergie ou des faisceaux d’électons pour détruire les cellules cancéreuses,
- la greffe de cellules souches ou de moelle osseuse qui permet de remplacer la moelle osseuse endommagée par des cellules saines,
- et enfin, l’immunothérapie qui stimule/éduque le système immunitaire pour qu’il reconnaisse et attaque les cellules cancéreuses.
C’est dans le cadre de l’immunothérapie que les cellules médicaments, les lymphocytes T-CAR (aussi appelées en Anglais CAR-T cells), ont été développées à l’issue de plus de trente années de recherche. Elles résultent d’approches innovantes conjuguant thérapie génique et thérapie cellulaire.
C’est quoi les lymphocytes T-CAR ?
Ce sont des lymphocytes T qui ont été génétiquement modifiés afin de produire une protéine appelée CAR, leur permettant de reconnaitre spécifiquement et de tuer des cellules cancéreuses.
CAR est un acronyme anglais signifiant Chimeric Antigenic Receptor ; en français, Récepteur Antigénique Chimérique.
Notre système immunitaire est constamment à l’affut d’intrus tels que les bactéries, les champignons, les virus et les cellules cancéreuses. Ces intrus sont détectés grâce à des protéines de notre système immunitaire inné capables de les reconnaître comme « étrangers » du fait de la présence à leur surface d’antigènes (c’est à dire de molécules diverses et/ou de protéines) différents de ceux de l’hôte. Lorsque cette alerte a été lancée, le système immunitaire adaptatif s’active avec la production de globules blancs, les lymphocytes B producteurs d’anticorps et les lymphocytes T destructeurs de cellules (voir sur ce site Immunologie). Malheureusement, les pathogènes, bactéries, champignons, virus ou les cellules cancéreuses peuvent parvenir à tromper le système immunitaire adaptatif ou à surpasser son action avec pour conséquence l’échappement de l’intru, conduisant à une infection ou à un cancer.
Et c’est là qu’interviennent les lymphocytes T-CAR
Production des lymphocytes T-CAR
Les lymphocytes T portent à leur surface des récepteurs antigéniques, qui sont des protéines dont le rôle est de reconnaître les antigènes « étrangers » présents, soit sur les cellules infectées (bactéries, virus, champignons), soit sur les cellules cancéreuses, et de s’y fixer pour les détruire.
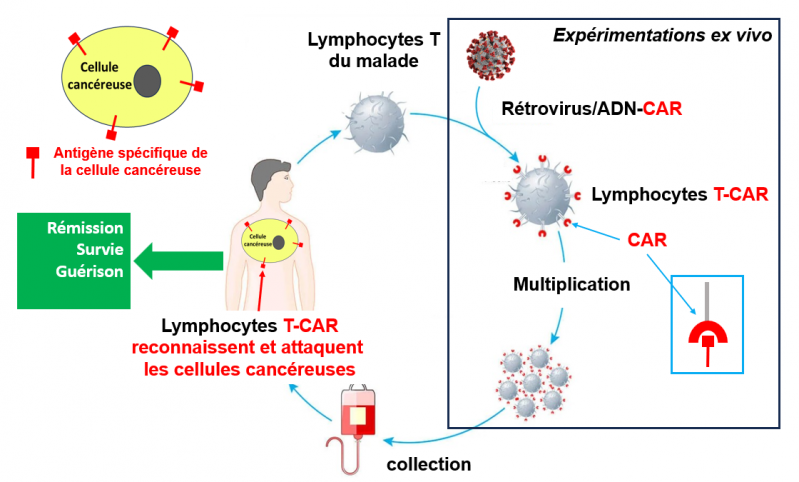
Afin de produire des lymphocytes T-CAR, on introduit dans les lymphocytes T du malade, via un rétrovirus non pathogène, le matériel génétique (ADN) nécessaire à la production d’un nouveau récepteur antigénique conçu pour cibler spécifiquement les cellules cancéreuses. Ce nouveau récepteur est constitué d’une partie du récepteur naturel des lymphocytes T, et d’une partie « ajoutée » qui permet de cibler spécifiquement l’antigène présent à la surface des cellules cancéreuses à éliminer. Ce nouveau récepteur est appelé CAR, « récepteur antigénique chimérique », le terme « chimérique » indiquant qu’il est une construction artificielle n’existant pas dans la nature (voir les figures plus bas dans la deuxième partie de cet article).
Utilisation des lymphocytes T-CAR comme cellules médicaments
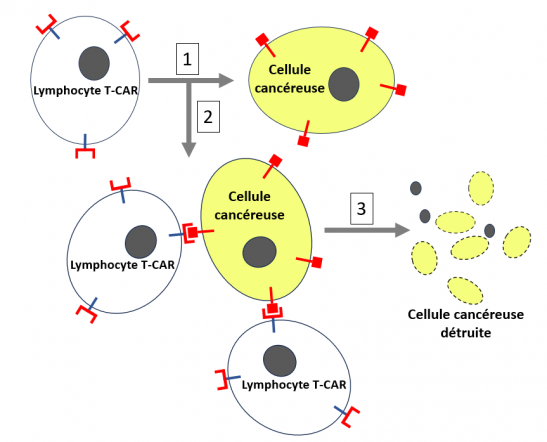
Après leur préparation, les lymphocytes T-CAR sont multipliés en laboratoire et collectés dans des poches. Ils sont transfusés chez le malade où ils continuent à se multiplier et partent à l’assaut des cellules cancéreuses qu’ils reconnaissent en se fixant via CAR sur leur antigène spécifique afin de les détruire, comme le montre la figure ci-dessous.
Utilisation des lymphocytes T-CAR en thérapie anticancéreuse
En haut à gauche, schéma d’une cellule cancéreuse qui exprime à sa surface un antigène spécifique, figuré par une étiquette rouge. Des lymphocytes T du malade sont prélevés et sont génétiquement modifiés afin qu'ils exprimer à leur surface le nouveau récepteur appelé CAR. Ces différentes expérimentations se font ex vivo (à l’extérieur du malade), dans un laboratoire spécialisé, figuré par le rectangle noir. Les lymphocytes T sont infectés par un rétrovirus non pathogène dans lequel l’ADN-CAR codant pour le récepteur chimérique CAR a été inseré. Cet ADN-CAR a été lui-même préalablement conçu et synthétisé par manipulations génétiques afin que la protéine (CAR) pour laquelle il code se positionne à la surface des lymphocytes T et reconnaisse les antigènes spécifiques de la tumeur (voir l’encart bleu). Ces lymphocytes sont alors multipliés en culture cellulaire de façon à en produire un très grand nombre. Ils sont ensuite collectés dans des poches, et transfusés au malade dans le corps duquel ils vont continuer à se multiplier et à attaquer les cellules cancéreuses.
Les lymphocytes T-CAR médicaments sur le marché
Aujourd’hui, six versions de ces cellules médicaments sont autorisées dans le traitement de cancers du sang chez l’enfant et l’adulte, et notamment, la leucémie lymphoblastique aiguë, le lymphome à grandes cellules B, le lymphome folliculaire, le lymphome du manteau, la leucémie lymphoïde chronique et le myélome multiple (cancer des cellules B). Chaque année un nombre croissant de malades bénéficient de cette immunothérapie, notamment dans les traitements de dernier recours, lorsque le cancer a atteint un stade avancé avec rechute ou résistance à la chimiothérapie ou à la radiothérapie.
Et les résultats sont spectaculaires, les taux de rémission partielle ou totale variant selon les pathologies sont de 48 à 98%
Effets indésirables de cette immunothérapie
Les traitements par lymphocytes T-CAR médicaments sont relativement récents. Leurs bénéfices autant que les risques liés à leur utilisation seront mieux connus dans les années qui viennent, mais les connaissances sur le sujet progressent. Outre les troubles relativement bénins (fièvre, frissons, fatigue, courbatures, maux de tête, vertiges), l’effet secondaire le plus préoccupant est le risque potentiel de cancer dit « secondaire », c’est-à-dire différent de celui ciblé par la thérapie, du fait de l’utilisation d’un rétrovirus lors de la préparation des lymphocytes T-CAR. En juillet 2024, le comité de pharmacovigilance des autorités de santé Européennes a confirmé l’existence de 38 cas de cancers secondaires liés aux cellules T-CAR (utilisées pour traiter des lymphomes et leucémies) sur environ 42 500 malades traités, ce qui représente moins de 0,1%. Les bénéfices de cette thérapie l'emportent donc largement sur les risques. Ce problème reste toutefois en cours d’investigation et les recherches visent à l’utilisation d’autres virus (et non de rétrovirus) mieux adaptés ou du remplacement des virus par des nanoparticules lipidiques non pathogènes.
Les recherches sur l’immunothérapie par lymphocytes T-CAR
Malgré les résultats très encourageants obtenus avec cette thérapie, il reste encore des malades atteints de maladies du sang qui ne bénéficient pas de rémission durable de leur cancer.
- Plusieurs mécanismes de rechute ont été identifiés à ce jour, notamment lorsque les cellules tumorales cessent d'exprimer l'antigène ciblé par les lymphocytes T-CAR, un processus appelé « échappement antigénique ». Les recherches se poursuivent activement dans ce sens.
- Un autre élément important à considérer concerne la durée d’attente entre le prélèvement des lymphocytes T du malade et leur perfusion une fois convertis en cellules médicament, appelée « temps de veine à veine ». Les recherches actuelles visent à réduire cette durée de préparation durant laquelle l'état clinique du malade peut se détériorer.
- Les recherches actuelles visent également à stimuler la prolifération de ces cellules après leur fabrication. En effet, dans les premiers essais cliniques, les malades qui présentaient les meilleures réponses antitumorales étaient ceux pour lesquels les lymphocytes T-CAR présentaient une meilleure prolifération.
- Les thérapies par lymphocytes T-CAR disponibles aujourd’hui sont des thérapies de deuxième intention après la chimiothérapie. Des essais cliniques évaluent maintenant cette thérapie comme traitement de première intention. Cela pourrait conduire à des lymphocytes T-CAR plus fonctionnels, parce que non exposés à la chimiothérapie, un thérapie qui endommagent les cellules.
- Actuellement, les cellules médicament T-CAR sont constituées de lymphocytes T provenant du malade lui-même. Cependant, des cellules T-CAR « prêtes à l'emploi », pourraient être fabriquées à partir de cellules prélevées sur des donneurs sains et modifiées de façon à éviter le rejet entre donneur et receveur. Ces cellules médicament pourraient être stockées jusqu'à leur utilisation et constituer ainsi une source quasi inépuisable du traitement.
- Enfin et malheureusement, l'efficacité de ces traitements par immunothérapie sur les tumeurs solides (cerveau, os, etc.) est encore limitée. Des recherches se poursuivent sur ce sujet brûlant.
- Un dernier aspect préoccupant de cette immunothérapie est son coût, qui se chiffre en centaines de milliers d’euros, ce qui peut constituer un obstacle majeur au traitement dans les pays qui ne possèdent pas un système de santé tel que le nôtre.
Conclusion
Bien que la thérapie par lymphocytes T-CAR ait été initialement développée pour le virus du SIDA, elle a gagné du terrain grâce à son application aux cancers du sang. Cette thérapie améliore la survie sans progression du myélome multiple, améliore la survie globale du lymphome à grandes cellules B et atteint des taux élevés de rémission pour la leucémie lymphoblastique aiguë, le lymphome folliculaire et le lymphome à cellules du manteau. Les recherches sur cette thérapie se poursuivent afin d’augmenter ses capacité thérapeutiques, de diminuer ses effets secondaires, et de pouvoir l’appliquer aux traitement des tumeurs solides. Elle est désormais prête à traiter un spectre plus large de pathologies comme l'auto-immunité, les infections chroniques, la fibrose et la sénescence. Nous commençons seulement à réaliser tout le potentiel de ce médicament vivant.
Pour celles et ceux qui désirent aller plus loin...
Les différentes étapes de la production des cellules médicaments T-CAR
La préparation et l’utilisation de ces cellules se font dans des services hospitaliers spécialisés ayant reçu l’autorisation des autorités de santé afin de pratiquer ce type de traitement.
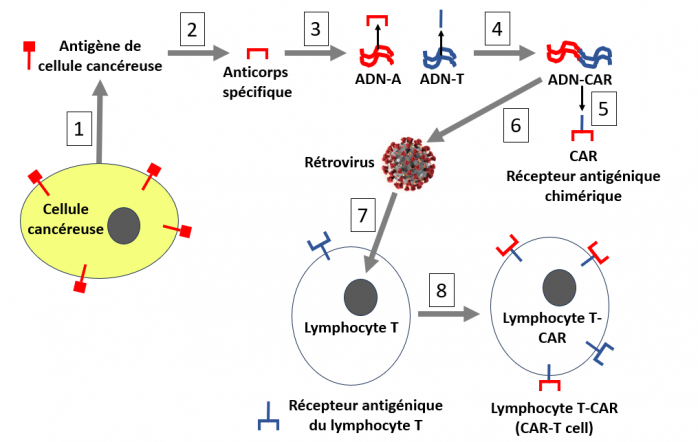
Production des lymphocytes T-CAR
1. La première étape consiste à identifier et prélever un antigène de surface spécifique des cellules cancéreuses (par exemple une protéine ou une molécule qui ne s’exprime que dans la tumeur, ou une protéine porteuse d’une mutation).
2. La deuxième étape consiste à préparer des anticorps spécifiques contre cet antigène de tumeur.
3. L’ADN codant : i) pour l’anticorps spécifique contre la tumeur et ii) pour la partie du récepteur des lymphocytes T permettant son ancrage dans la membrane cellulaire est préparé.
4. Ces deux ADN sont liés par manipulation génétique afin de coder pour le récepteur chimérique (CAR).
5 et 6. L’ADN codant pour le CAR est introduit dans un rétrovirus.
7. Des lymphocytes T cytotoxiques sont prélevés chez le malade et sont modifiés génétiquement en laboratoire par infection avec un rétrovirus porteur de l’ADN codant le récepteur chimérique (CAR).
8. Ces lymphocytes expriment alors à leur surface le récepteur chimérique CAR capable de s’arrimer à l’antigène spécifique présent sur la surface des cellules cancéreuses à éliminer.
Utilisation des cellules T-CAR en clinique
Utilisation des lymphocytes T-CAR
1. Les lymphocytes T-CAR ciblent (se fixent sur) les cellules cancéreuses qui portent l'antigène spécifiquement reconnu par le CAR.
2-3. Plusieurs lymphocytes T-CAR peuvent se fixer sur une seule cellule cancéreuse et la détruire.
Les cellules T-CAR médicaments sur le marché
Aujourd’hui, six versions de ces cellules sont autorisées dans le traitement de cancers du sang chez l’enfant et l’adulte, et notamment, la leucémie lymphoblastique aiguë, le lymphome à grandes cellules B, le lymphome folliculaire, le lymphome du manteau, la leucémie lymphoïde chronique et le myélome multiple (cancer des cellules B). Les antigènes ciblés sont le CD19, une protéine membranaire des lymphocytes B, dans les leucémies et les lymphomes, ou l’antigène de maturation des lymphocytes B dans du myélome multiple (Cohen et al. New Engl J Med 2025; Brudno et al. JAMA 2024; Baker et al. Nature 2023; Rosenberg, Science 2024; Labanieh and MacKall Nature 2023). Chaque année un nombre croissant de malades bénéficient de ces cellules T-CAR, notamment dans les traitements de dernier recours lorsque le cancer a atteint un stade avancé, avec rechute ou résistance à la chimiothérapie ou radiothérapie. Et les résultats sont spectaculaires, les taux de rémission partielle ou totale variant selon les pathologies de 48 à 98%.
Les effets indésirables des cellules T-CAR
Les traitements par lymphocytes T- CAR sont relativement récents. Leurs bénéfices autant que les risques liés à leur utilisation seront mieux connus dans les années qui viennent. Dans le cadre du traitement de cancers, leurs différents effets secondaires déclarés à ce jour sont : i) un syndrome pro-inflammatoire avec fièvre, frissons, fatigue, courbatures (Davila et al. Sci Transl Med 2014; Grupp et al. New Engl J Med 2013) ; ii) des troubles neurologiques : maux de tête, vertiges, difficultés à parler, crises d’épilepsie (Lee et al. Biol Blood Marrow Transplant. 2019; Kochenderfer et al. J Clin Oncol 2015; Karschnia et al. Blood 2023) ; iii) une baisse importante des globules blancs, en raison du traitement immunosuppresseur qui précède l’injection de cellules T-CAR, à l’origine d’infections secondaires (Kampouri et al. Transpl Infect Dis 2023; Kampouri et al. Transpl Infect Dis 2023; Hill, Blood 2020) ; iv) l’effet secondaire les plus préoccupant est le risque potentiel de cancer dit « secondaire », c’est-à-dire différent du premier, après traitement par cellules T-CAR (Verdun and Marks New Engl J Med 2024; Levine et al. Nat Med 2024; Barone et al. Br J Haematol 2024; Prasad JAMA 2024). Ces cancers secondaires pourraient résulter du processus de génie génétique (vecteur rétroviral) de production des lymphocytes T-CAR par insertion de l’ADN de CAR à proximité des régions génétiques contrôlant la croissance des cellules T. Ce phénomène pourrait provoquer des tumeurs malignes, via un processus appelé mutagenèse insertionnelle. En juillet 2024, le comité de pharmacovigilance de l’EMA a confirmé l’existence de 38 cas de cancers secondaires liés aux lymphocytes T-CAR (lymphome, leucémie) sur environ 42 500 patients traités, ce qui représente moins de 0,1% (ANSM). Les bénéfices de cette thérapie par cellules T-CAR l'emportent donc largement sur les risques. Ce questionnement est toutefois en cours d’investigation et de surveillance.
Comment améliorer la thérapie par cellules T-CAR
Bien que cette immunothérapie donne des résultats très encourageants, encore trop de patients atteints de lymphome ou de leucémie lymphoblastique aiguë à cellules B n'obtiennent pas de rémission durable. Plusieurs mécanismes auxquels ces rechutes pourraient être liées ont été identifés à ce jour.
Echappement antigènique
Ce phénomène résulte de l'évolution génétique de la tumeur maligne qui, soit n'exprime plus l'antigène ciblé par les cellules T-CAR, soit exprime l'antigène à un niveau trop faible, soit l'exprime sous une forme altérée qui n'est plus reconnue par les lymphocytes T-CAR (Munshi et al. New Engl J Med 2021; Plaks et al. Blood 2021; Laetsch et al. J Clin Oncol 2023).
Un premier exemple est celui des cellules T-CAR dirigées contre l'antigène CD22 des cellules B pour traiter une leucémie lymphoblastique aiguë à cellules B qui n'exprimait plus l’antigène CD19 après une première thérapie par cellules T-CAR anti-CD19. Cette stratégie utilisant des lymphocytes T-CAR anti-CD22 a montré son efficacité dans des essais cliniques (Fry et al. Nat Med 2018).
Un deuxième exemple est celui de cellules T-CAR dirigées contre l'antigène récepteur couplé à la protéine G. Ces cellules ont démontré des preuves précoces d'efficacité pour les patients atteints de myélome multiple qui avaient rechuté après une thérapie par lymphocytes T-CAR anti-BCMA (Mailankody et al. New Engl J Med 2022).
Un troisième exemple est celui d’une étude de phase 1 menée auprès de patients atteints de myélome multiple qui avaient rechuté après une thérapie par cellules T-CAR anti-BCMA. Les cibles antigéniques alternatives actuellement testées pour ce cancer combinent deux antigènes, CD79b et CD37 (Frigault et al. Blood 2024; Scarfo et al. Blood 2018).
Enfin, pour le traitement du lymphome à cellules B, le ciblage simultané de plusieurs antigènes comme CD19 et CD20 pour empêcher l'échappement antigénique, est en cours d'investigation (Zah et al. Cancer Immunol Res 2016).
Qualité des cellules T collectées chez le malade
Dans certains cas, la faible efficacité du traitement par cellules T-CAR pourrait résulter de la mauvaise qualité des lymphocytes T collectées chez le malade lui-même, ou d'une plus faible capacité de ces cellules à proliférer (Lin et al. Nat Med 2023; Fraietta et al. Nat Med 2018; Locke et al. Blood Adv 2020). Ce phénomène pourrait être lié aux traitements antérieurs (chimiothérapie, notamment, un thérapie qui endommagent les cellules) auxquels le malade a été précédemment exposé pour tenter de traiter son cancer.
Réduction du "temps de veine à veine"
Un élément important à prendre en compte concerne la durée d’attente entre la leucaphérèse (prélèvement des cellules T du malade) et la perfusion de cellules T-CAR, appelée "temps de veine à veine". Lors des essais cliniques et d'utilisation commerciale de cette thérapie, jusqu’à 31 % des patients n'ont pu recevoir de perfusion de cellules T-CAR en raison de retard dans la fabrication de ces cellules ou, plus fréquemment, d'une détérioration de leur état clinique en raison d'une progression maligne pendant l'attente de ces cellules (Hanssen et al. J Clin Oncol 2023; Schuster et al. New Engl J Med 2019; Fowler et al. Nat Med 2022; Neelapu et al. New Engl J Med 2017; Munshi et al. New Engl J Med 2021).
Réduire les effets indésirables du syndrome pro-inflammatoire et des troubles neurologiques
Les traitements pharmacologiques visant à réduire les toxicités aiguës liées aux cellules T-CAR évoluent. Des modèles murins (souris) ont suggéré que le blocage de l’interleukine 1 (IL-1) pourrait prévenir ou réduire les effets indésirables du syndrome pro-inflammatoire et des troubles neurologiques (Norelli et al. Nat Med 2018; Giavridis et al. Nat Med 2018; . Des essais prospectifs ont suggéré que l’utilisation prophylactique ou l’intervention précoce avec le tocilizumab (anticorps monoclonal contre l’IL-6), l’anakinra (antagoniste du récepteur de l’IL-1), ou de faibles doses de glucocorticoïdes peuvent prévenir les toxicités sévères du syndrome de libération de cytokines et du syndrome de neurotoxicité associé aux cellules effectrices immunitaires (Gardner et al. Blood 2019; Caimi et al. Front Immunol 2021; Park et al. Nat Med 2023). D’autres essais ont montré que les thérapies anticytokines, telles que le tocilizumab, le siltuximab (un autre anticorps monoclonal contre l’IL-6), l’anakinra (lantagoniste de l’IL-6), et l’emapalumab (anticoprs monoclonal contre l’IFN-γ), permettent un traitement des toxicités insensibles aux glucocorticoïdes (Bajwa et al. Blood 2023; Gazeau et al. Transpl Cell Ther 2023; McNerney et al. Blood Cancer Discov 2022).
Modifier de la structure du CAR
La modification de la structure du CAR peut également modifier le profil de toxicité des cellules T-CAR, notamment en diminuant l’expression des cytokines et d’autres protéines immunologiques sécrétées par les cellules T-CAR et par d’autres cellules immunitaires dans le sang du patient, sans diminuer l’efficacité du traitement (Brudno et al. Nat Med 2020). Par exemple, des essais cliniques ont montré que les effets indésirables du syndrome de libération de cytokines et/ou du syndrome de neurotoxicité associé aux cellules effectrices immunitaires peuvent être réduits en modifiant la force de liaison de la région de reconnaissance de l’antigène sur le CAR à l’antigène associé au cancer. Ces toxicités peuvent également être diminuées en modifiant la séquence des domaines charnière et transmembranaire qui relient la région de reconnaissance de l’antigène extracellulaire aux composants intracellulaires qui activent la cellule T, et en modifiant la structure du domaine d’activation des cellules T. L’évaluation clinique des lymphocytes T- CAR avec des structures CAR modifiées et le développement de thérapies par cellules T-CAR moins toxiques peuvent permettre une utilisation plus large de cette thérapie (Roddie et al. J Clin Oncol 2021; Park et al. Blood 2023).
Améliorer les conditions de culture et d'expansion des cellules T-CAR
Lors les premiers essais cliniques, que ce soit dans les cas de leucémies ou de lymphomes multiples, les patients qui présentaient les meilleures réponses antitumorales étaient ceux pour lesquels les cellules T-CAR présentaient une meilleure prolifération (Porter et al. Sci Transl Med 2015). Les stratégies potentielles pour améliorer l'efficacité et augmenter l'expansion des cellules T-CAR et leur efficacité in vivo incluent la modification du processus de culture cellulaire pour sélectionner des cellules T à phénotype moins différencié, ce qui peut améliorer leur efficacité (Sabatino et al. Blood 2016).
Utiliser les cellules T-CAR en première intention
Les thérapies par cellules T-CAR disponibles dans le commerce sont généralement approuvées comme thérapies de deuxième intention ou ultérieures pour les tumeurs hématologiques malignes. Des essais cliniques évaluent maintenant cette thérapie comme traitement de première intention, c'est à dire administrée plus tôt au cours du traitement que ce qui avait été approuvé auparavant.
Ainsi, dans l'essai clinique ZUMA-12, 40 patients atteints d'un lymphome à grandes cellules B à haut risque ont été traités par des cellules T-CAR après rechute, suite à 2 cycles de chimiothérapie standard comme premier traitement. Chez ces patients, une proportion plus élevée de lymphocytes T moins différenciées et plus prolifératifs a été identifiée dans les cellules T-CAR pré-infusion. La thérapie par cellules T-CAR plus tôt dans le cycle de traitement peut conduire à des cellules plus fonctionnelles, peut-être parce que ces cellules ont été exposées à moins de chimiothérapies antérieures, un thérapie qui endommagent les cellules (Neelapu et al. Nat Med 2022).
Utiliser des cellules T-CAR prêtes à l'emploi
Actuellement, les cellules T-CAR approuvées par les autorités de santé et celles en phase avancée d'essais sont constituées de cellules T autologues (provenant du malade lui-même). Cependant, des cellules T-CAR fabriquées à partir de cellules prélevées sur des donneurs sains et stockées jusqu'à leur utilisation, appelées « cellules CAR-T prêtes à l'emploi » (cellules allogéniques) pourraient représenter une source intéressante. Bien que séduisante, cette alternative présente un inconvénient. En effet, les cellules T-CAR prêtes à l'emploi auront toutes les chances d'être rejetées par le système immunitaire de l'hôte. De fait, des essais de phase précoce sont en cours (Benjamin et al. Lancet Haematol 2022). En général, les technologies d'édition génomique (CRISPR-Cas) sont utilisées pour supprimer le récepteur des lymphocytes T afin de prévenir la maladie du greffon contre l'hôte. Pour éviter cela, des doses plus élevées de chimiothérapie et, dans certains cas, la perfusion d'anticorps monoclonaux contre CD52 sont utilisées pour prolonger l'épuisement des cellules T. Des preuves précoces de l'efficacité de ces cellules dirigées contre CD19 et BCMA sont disponibles (Mailankody et al. Nat Med 2023). Elles permettent des délais plus courts entre la collecte des cellules et leur ré-infusion, par rapport aux cellules T-CAR actuellement disponibles dans le commerce. Cependant, les thérapies de conditionnement qui épuisent les cellules T augmentent les taux d'immunosuppression à long terme et les taux d'infections virales opportunistes, telles que le cytomégalovirus (Brudno et al. Nat Rev Clin Oncol 2024).
Problèmes liés au coût trop élevé de cette thérapie
Enfin, une préoccupation majeure de cette thérapie est son coût, qui se chiffre en centaines de milliers de dollars. Ceci constitueun obstacle majeur au traitement dans les pays qui ne possèdent pas un système de santé performant. Il est clair que les malades ne disposant pas d’une assurance maladie auront un accès limité ou nul à cette thérapie. De fait, moins de 1 % des bénéficiaires de cellules T-CAR n'ont pas d'assurance ou d'autre payeur (Rubin, JAMA 2019; Allen et al. Mol Ther Methods Clin Dev 2023; Ahmed et al. Transplant Cell Ther 2022).
Cancers à tumeurs solides
L'efficacité des traitements par cellules T-CAR pour les tumeurs solides a été limitée, bien que des réponses tumorales aient été observées dans certains cancers, et que d'autres types de traitements à base de lymphocytes T aient obtenu l'approbation des autorités de santé (Schmidts and Maus Front Immunol 2018; Norberg and Hinrichs Cancer Cell 2023; Del Bufalo et al. New Engl J Med 2023). Des recherches en laboratoire dans lesquelles des souris ont été implantées avec des tumeurs solides pour modéliser le traitement du cancer ont identifié des facteurs liés aux lymphocytes T qui influencent l'efficacité du traitement, tels que la capacité de ces cellules T-CAR à migrer vers la tumeur, à proliférer et à rester viables chez l’animal ; à surmonter les facteurs inhibiteurs tels que le facteur de croissance TGF-β qui imprègne le microenvironnement tumoral ; et à maintenir leurs fonctions antitumorales (Zheng et al. Mol Ther 2025; Liang et al. Cell Mol Immunol 2024; Tran et al. J Immunother Cancer 2024; Tang et al. JCI Insight 2020). On ne sait toujours pas lequel de ces mécanismes, le cas échéant, limite l'efficacité du traitement chez l'homme. Les principales limitations de la thérapie cellulaire et d’autres immunothérapies peuvent être dues à des facteurs spécifiques des cellules tumorales, tels que l’expression de l’antigène cible, la présentation de l’antigène et la sensibilité aux molécules effectrices des lymphocytes T. L’identification et le ciblage de cibles « propres », des structures moléculaires spécifiques dans les cellules cancéreuses qui peuvent être ciblées sans toxicité grave, due à des lésions des cellules saines, restent un défi majeur.
Conclusion
Bien que la thérapie T-CAR ait été initialement développée pour le VIH, elle a gagné du terrain grâce à son application aux hémopathies malignes. La thérapie par cellules T-CAR approuvée par les autorités de santé améliore la survie sans progression du myélome multiple, améliore la survie globale du lymphome à grandes cellules B et atteint des taux élevés de rémission du cancer pour d'autres hémopathies malignes telles que la leucémie lymphoblastique aiguë, le lymphome folliculaire et le lymphome à cellules du manteau.
Les recherches sur cette thérapie se poursuivent afin d’augmenter ses capacité thérapeutiques, de diminuer ses effets secondaires, et de pouvoir l’appliquer aux traitement des tumeurs solides.
La thérapie T-CAR est désormais prête à traiter un spectre beaucoup plus large de pathologies. Les technologies émergentes dans la conception et l'administration de l'ADN de CAR amplifient ce potentiel. Les applications théoriques sont vastes et la plateforme est puissante. La thérapie T-CAR est également prometteuse pour traiter l'auto-immunité, les infections chroniques, la fibrose et la sénescence, et peut favoriser un vieillissement en bonne santé. Nous commençons seulement à réaliser tout le potentiel de ce médicament vivant.
Date de dernière mise à jour : 24/03/2025
Ajouter un commentaire