THERAPIES D'ARN
Les thérapies d'ARN
Résumé tout public
La vie de tous les organismes vivants (microorganismes, plantes, insectes, animaux) repose sur trois éléments de base : ADN, ARN et protéines. L’ADN est constitué d’une séquence de 4 nucléotides (symbolisés par les 4 lettres A, T, G, C) qui contient toute l’information génétique nécessaire au développement de l’individu et en particulier (mais pas exclusivement) à la production de protéines qui assurent l’immense majorité de ses fonctions biologiques spécifiques.
Dans ce rôle fondamental, l’ADN n’intervient pas directement ; il reste cantonné dans le noyau cellulaire, mais utilise un intermédiaire, l’ARN messager (ARNm) qui sera traduit en protéine.
La figure ci-dessous explique comment les trois éléments de base, ADN, ARN et protéine sont liés.
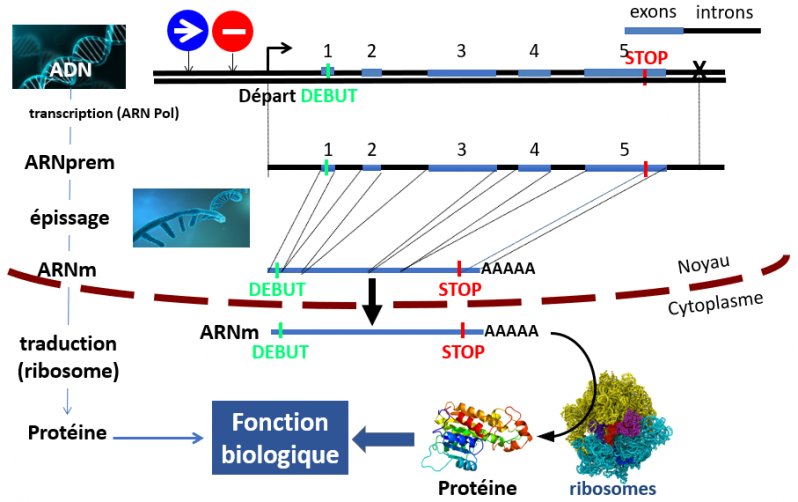
Cette figure présente le "dogme" de la biologie moléculaire. De haut en bas:
L'ADN en double brin comportant des exons (rectangles bleus) et des introns (ligne noire). Seuls les exons codent pour une protéine. L'expression du gène est contrôlée par des séquences "accélérateurs" (bleu) et des séquences "freins" (rouge) permettant d'adapter l'activité du gène au contexte biologique.
L'ARNprem en simple brin est synthétisé dans le noyau par l'ARN polymérase (ARN pol). Il est une copie fidèle du brin codant de l'ADN (celui du haut sur la figure). Il subit ensuite une opération d'épissage, étape au cours de laquelle les séquences des introns sont retirées et dégradées et les séquences des exons sont assemblées pour former l'ARN messager (ARNm).
Une fois constitué, l'ARNm sort du noyau et rejoint le cytoplasme où il est traduit en protéine par les ribosomes.
Ce sont les protéines qui assurent les fonctions biologiqies de l'organisme.
Les ARN-médicaments dans l’arsenal de la pharmacologie
Jusqu’à il y a une vingtaine d’années, l’immense majorité des médicaments était constituée par des petites molécules telles que les antibiotiques, les antiinflammatoires, les anticancéreux, les antiallergiques, les antalgiques, etc. Avec l’avènement de la génétique et de la biologie cellulaire, de nouvelles approches de biothérapie ont vu le jour comme par exemple les thérapies géniques et les thérapies cellulaires.
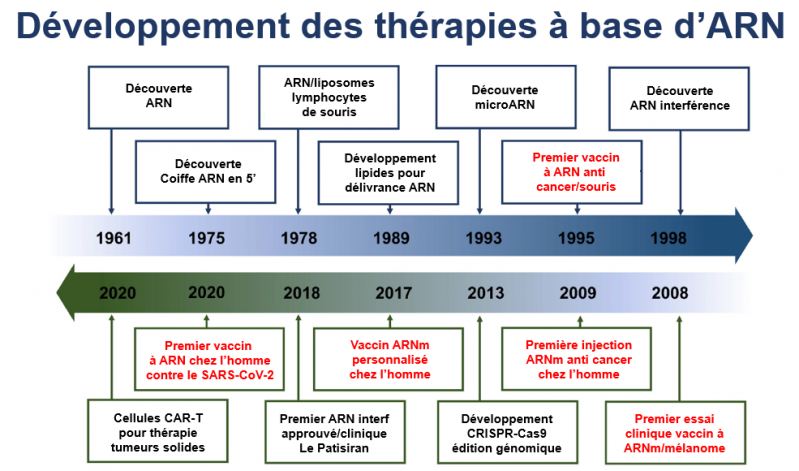
Mais pour le grand public, ce n’est que depuis le début 2020 que les ARN-médicaments ont fait une entrée remarquée dans l’arsenal de la pharmacologie avec les vaccins anti-SARS-CoV-2, le virus responsable de la COVID-19. En réalité, depuis 1961, date de leur découverte, les ARN-médicaments n’ont cessé d’être développés comme le montre la figure ci-dessous.
Les ARN-médicaments sont appelés à jouer un rôle important dans le traitement de nombreuses maladies, soit parce qu’ils sont acteurs (ARN-médicaments à proprement parler), soit parce qu’ils sont cibles de ces thérapies. La figure ci-dessous montre les 4 points principaux sur lesquels les ARN-médicaments peuvent intervenir.
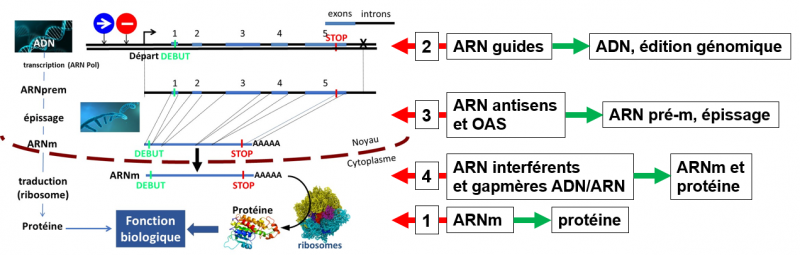
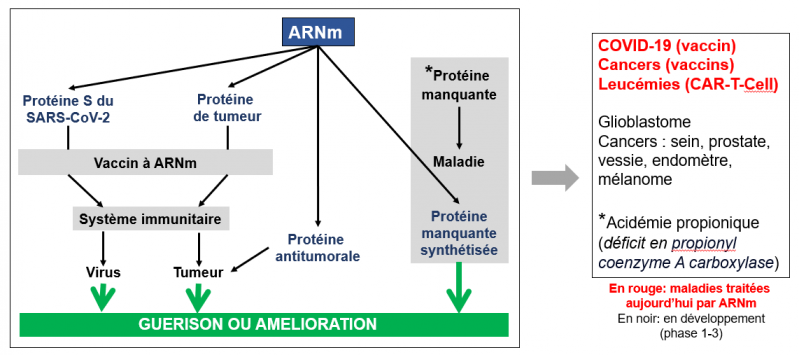
Cas 1. ARN messager (ARNm). L’ARNm est utilisé comme ARN-médicament dans le but de produire une protéine. Par exemple, dans le vaccin contre le SARS-CoV-2 c’est la protéine virale S qui est produite afin de booster le système immunitaire contre le virus. Dans les vaccins et traitements anticancer, l’ARNm produit une protéine cible des tumeurs afin d’y diriger le système immunitaire, ou une protéine qui permet de réduire la prolifération des cellules tumorales. Enfin, dans les pathologies liées à l’absence d’une protéine essentielle (certaines maladies rares), cette stratégie permet de produire la protéine manquante.
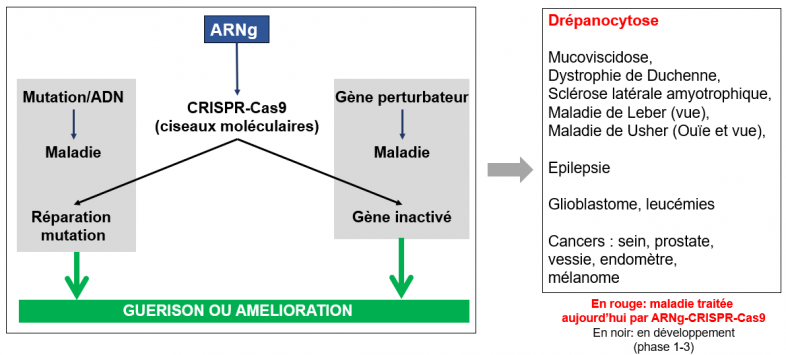
Cas 2. ARN guides (ARNg). Les ARNg sont des petits ARN-médicaments (constitués de 20 à 30 nucléotides) impliqués dans l’édition génomique (acronyme : CRISPR-Cas9 ou ciseaux moléculaires). Leur rôle est de conduire (guider) très précisément sur le site d’une mutation ou sur un gène perturbateur, une enzyme (Cas9) qui va couper l’ADN à un endroit prédéfini, soit afin de corriger la mutation génétique, soit afin de modifier l’expression du gène perturbateur. Cette stratégie, approuvée pour le traitement de la drépanocytose (une maladie de l’hémoglobine), est en cours de développement pour le traitement de nombreuses maladies et de cancers.
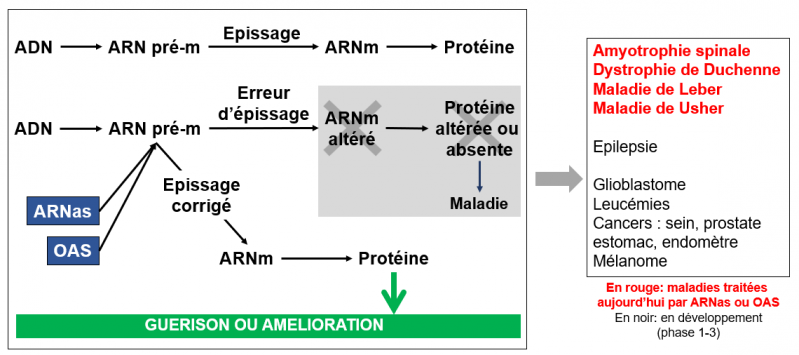
Cas 3. ARN antisens (ARNas) et oligonucléotides antisens (OAS). Les ARNas sont des petits ARN-médicaments (constitués de 20 à 30 nucléotides). Les OAS-médicaments sont constitués de ribonucléotides (ARN) et de désoxyribonucléotides (ADN). Leur cible, l’ARN pré-messager. L’épissage de l’ARNpré-m en ARNm est une étape essentielle dans l’expression des gènes. Elle se déroule dans le noyau cellulaire. Elle permet la synthèse de l’ARNm par élimination des introns présents dans le gène. Un dysfonctionnement dans cette étape est responsable de nombreuses maladies, maladies rares, et cancers résultant d’erreurs commises par la machinerie cellulaire, le plus souvent du fait de mutations génétiques. Les ARNas et les OAS sont administrés pour corriger ces erreurs d’épissage.
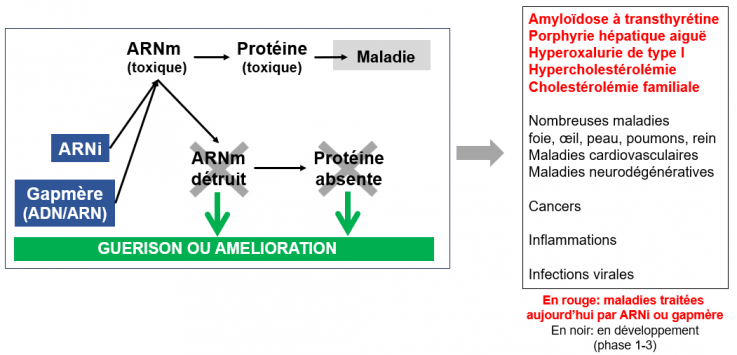
Cas 4. ARN interférents (ARNi) et gapmères. Les ARNi sont de petits ARN-médicaments (constitués de 20 à 30 nucléotides), tandis que les gapmères sont des oligonucléotides-médicaments hybrides, constitués de ribonucléotides (constituants des ARN) et de désoxyribonucléotides (constituant de l’ADN). Leurs cibles, les ARNm. Il arrive qu’une protéine ou un ARN soit toxique pour l’organisme, le plus souvent du fait de mutations génétiques, mais aussi du fait de leur origine (exemple, virus). Il peut en résulter des nombreuses pathologies (maladies, maladies rares, cancers). Ces ARNi ou ces gapmères sont administrés pour bloquer la production d’un ARNm toxique et/ou par voie de conséquence, d’une protéine toxique. Au moins 5 ARNi et gapmères sont actuellement sur le marché.
Les ARN-médicaments : préparation, formulation et administration
Contrairement à l’ADN qui est très stable du fait de sa structure en double brin, les ARN dont la structure est en simple brin sont très instables. Dès leur administration ils sont la proie des nombreuses nucléases (ribonucléases, endo et exonucléases) et de phosphatases, présentes dans le sang et les tissus. C’est un premier obstacle majeur que les chercheurs ont dû franchir pour utiliser les ARN comme médicament. Mais ce n’est pas le seul. Les ARN administrés directement ne rentrent pas dans les cellules. De plus, ils sont immunogènes, c’est à dire que leur présence dans l’organisme déclenche une réaction immunitaire innée très intense.
De nombreux travaux ont donc été entrepris au cours de 40 dernières années afin de tenter de pallier ces inconvénients. La figure ci-dessous montre l’ensemble des développement à réaliser pour permettre à un ARN de devenir un médicament.
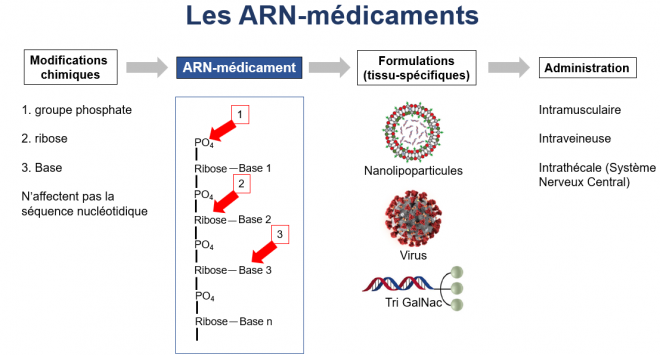
Première étape, l’ARN doit être chimiquement modifié soit sur les groupements phosphates (1), soit sur les riboses (2), soit sur les bases (3) d’une part pour être protégé des nucléases et d’autre part pour éliminer son immunogénicité.
Deuxième étape, il doit ensuite être encapsulé pour être protégé des nucléases du sang soit dans des nanoparticules lipidiques, soit dans des virus. Une autre possibilité est de coupler l’ARN à une molécule qui va le stabiliser comme par exemple les dérivés N-acétylgalactosamine (GalNac). De nombreux autres types de tels dérivés sont actuellement à l'étude.
Troisième étape, il doit pouvoir être dirigé sur le tissu ou l’organe à traiter et cela se fait en modulant la composition des lipides et autres constituants des nanoparticules ou par la nature des virus utilisés. Par exemple, un ARN couplé au Tri GalNac va aller très rapidement dans le foie.
Enfin l’administration peut se faire via plusieurs voies, intramusculaire, intraveineuse, ou intrathécale, cette dernière étant pour l’heure la meilleur pour atteindre le système nerveux central.
Les ARN-médicaments déjà sur le marché
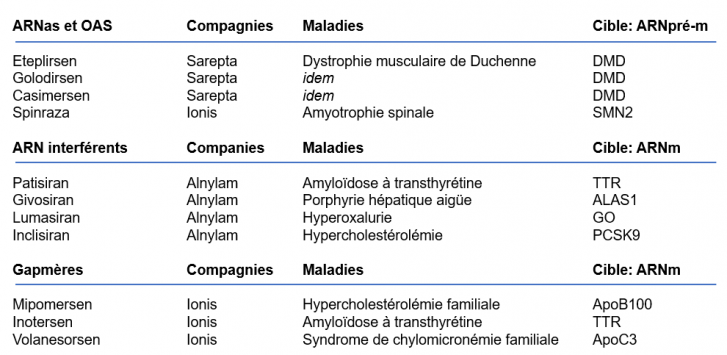
TTR: transthyrétine ; ALAS1: Aminolévulinate synthase 1 ; GO: Glycolate oxydase ; PCSK9: Proprotéine convertase subtilisine/kexine-type 9 ; Apo-B-100: apolipoprotéine B100 ; APOC3: apolipoprotéine C3 ; SMN2: survie des motoneurones-2
Avantages et inconvénients des thérapies d'ARN
Avantages des ARN-médicaments
- Très forte spécificité
- Facilité de mise en œuvre
- Pas de risque d’intégration génomique
- Relative sécurité
- Facilité de production
- Polyvalence. Toute maladie, notamment celles d'origine génétique
- Personnalisation possible du traitement
Inconvénients des ARN-médicaments
- La séquence de la cible doit être connue
- Instabilité des ARN
- Recours à des modifications chimiques
- Recours à des modes d’administration élaborés
- Ciblage d’organe encore à développer (cerveau)
- Répétition du traitement
- Coût élevé des traitements
Conclusion
Les thérapies d’ARN sont issues d’une longue histoire:
- 1961 découverte de l’ARN
- 1995 premier vaccin à ARN chez la souris
- 1998 découverte de l’interférence par ARN et premiers ARN-médicaments
- 2013 découverte de l’édition génomique CRISPR-Cas
- 2008-2009 premier vaccin à ARN/mélanome chez l’homme
- 2020-2021 premier vaccin à ARN contre le SARS-CoV-2
- 2023 CRISR-Cas première approbation sur la drépanocytose
Les développements de la chimie des oligonucléotides et des vecteurs de délivrance de ces ARN ont permis la mise en place de ces thérapies dans les dix dernières années. Aujourd’hui les ARN-médicaments sont en plein développement pour un grand nombre de maladies métaboliques, neurologiques, neuromusculaires, etc., et pour le traitement des cancers et des maladies rares. Le coût très élevé de ces thérapies limite toutefois, et pour le moment, leur utilisation aux pays les plus riches.
Pour aller plus loin, à venir...
Date de dernière mise à jour : 12/07/2024
Ajouter un commentaire
